MDR: the time is now
“Tussen januari 2022 en mei 2024 vervallen 11.000 MDD-certificaten”
Sinds 26 mei 2021 beschermt de MDR de gezondheid en veiligheid van alle EU-burgers. Wat de nieuwe Medical Device Regulation (MDR) precies inhoudt, kon je al ontdekken in een eerdere blog. In deze vervolgeditie focussen we op de belangrijkste praktische aandachtspunten voor ziekenhuizen. Want het is belangrijk om alle medische hulpmiddelen die je nu gebruikt (en waarvan de komende jaren de MDD certificering verloopt), op tijd te vervangen door nieuwe medische hulpmiddelen (die wél voldoen aan de strengere MDR-regels).
Hoe je dat het beste aanpakt, lees je hieronder.
Start met een goede inventarisatie, ook voor medische software
Om op een efficiënte manier de stap van MDD naar MDR te zetten, start je het best met een inventarisering van alle medische hulpmiddelen — inclusief software — in je ziekenhuis. Noteer daarbij:
- je producent/fabrikant
- je leverancier (de producent zelf, een distributeur of een integrator)
- de MDD-certificering en de geldigheidsduur ervan
- de intended use (wat doet het medische hulpmiddel?) en de CE klasse
- de bevestiging dat het medische hulpmiddel (niet) voldoet aan alle MDR-eisen
Deze inventarisatie is de uitgelezen voorbereiding om te zorgen dat je toe kunt werken naar de aankoop en het gebruik van medische hulpmiddelen die voldoen aan alle MDR-eisen.
Medische software kan je blijven gebruiken tot de einddatum die op het ‘MDD CE’-certificaat staat.
Strengere MDR-eisen
Ja, mei 2024 lijkt nog ver weg. En ja, het is de verantwoordelijkheid van de producent dat het medische product voldoet aan de wettelijke MDR-eisen. Maar toch is het risicovol om alles gewoon maar op zijn beloop te laten. Je houdt er het best rekening mee dat producten straks mogelijk niet meer leverbaar zijn en/of duurder worden (vanwege hogere kosten voor certificering en het uitvoeren van clinical evaluation en Post Market Surveillance). Neem daarom zelf contact op met de leverancier om te controleren of de producent de MDR-deadline haalt.
In je overleg met de leverancier focus je het best op de strengere MDR-eisen voor risicomanagement en klinische validatie. Bespreek in het gesprek de plannen van de leverancier, aan de hand van deze vragen:
- Wat is de intended medical purpose?
- Wat is de medische claim?
- Wat brengt dit de patiënt en hoe bewijst de producent dat in de klinische praktijk?
- Hoe weet je dat de risico’s van het product in verhouding staan met wat de medische software brengt?
Eudamed: eerste stap van MDD naar MDR
Om tijdig MDR-certificatie te realiseren, moeten de producenten, gemachtigd vertegenwoordigers en importeurs, zichzelf registreren in Eudamed (de Europese databank met informatie over alle medische hulpmiddelen). Onderdeel hiervan is ook welke persoon is benoemd tot Person Responsible for Regulatory Compliance (PRRC).
Na registratie ontvangt het bedrijf een Single Registration Number (SRN). Zonder dit SRN kun je geen MDR-certificering starten. Vanaf 1 december 2020 moeten leveranciers van medische hulpmiddelen zich registreren in Eudamed. Heeft de producent een SRN?
Met Eudamed op weg naar transparantie
“Wat is het voordeel van die centrale registratie in Eudamed?”, vraag je je misschien af. Wel: dankzij Eudamed is de informatie over medische hulpmiddelen beter bereikbaar voor het publiek en voor zorgverleners. Op die manier vergroot de transparantie in heel Europa. Bovendien is het vanaf nu verplicht om in het kader van de MDR alle medische hulpmiddelen met een unieke UDI-code te registreren. Dit zorgt voor betere traceerbaarheid. Eudamed wordt komende jaren bovendien uitgebreid met modules voor uitgevoerde klinische onderzoeken, vigilantie en Post Market Surveillance en het marktoezicht. Alle incidenten met medische hulpmiddelen worden zo volledig zichtbaar.
Specifieke MDR-eisen voor updates, upgrades en wijzigingen in intended use van medische software
Vanaf de overgang van MDD naar MDR – in mei 2021 – gelden er heldere eisen voor mogelijke updates, upgrades en ‘intended use’-veranderingen van je MDD gecertificeerde software. Deze staan beschreven in Medical Devices Coordination Group Document 2020-03:
- Alleen kleine wijzigingen mogen nog worden doorgevoerd
- Voor ‘notifyable changes’ moet de producent goedkeuring vragen aan de ‘notifying body’ (NB). Vraag daarom vooraf aan je leverancier of updates en upgrades van je nieuwe medische software ‘notyfiable changes’’ bevat, zoals beschreven in MDGC2020-03. En aan welke notyfying body deze ter goedkeuring zijn voorgelegd.
Stap op tijd over van MDD naar MDR
Over ‘notifying bodies’ gesproken … Op dit moment zijn er 25 notifying bodies in Europa, waarvan 3 in Nederland en 1 in België. Het aantal instanties dat nu conform MDR kan certifiëren is dus beperkt. Dit confronteert de producenten met een grote uitdaging. Want de toekenning vergt uiteraard de nodige tijd. En tegelijk verlopen tussen januari 2022 en mei 2024 meer dan 11.000 MDD-certificaten (zie grafiek).
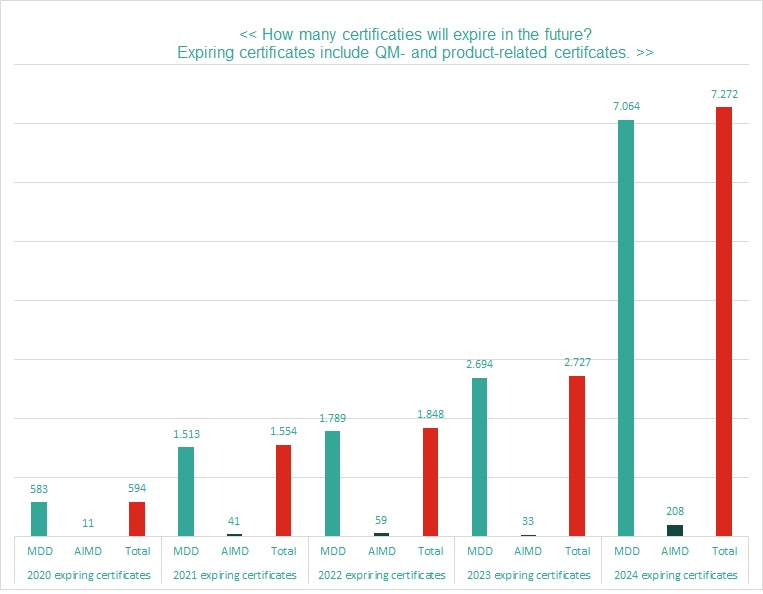
De combinatie van die twee factoren leidt tot een moeilijke spagaat. Daarom is het belangrijk dat de producenten zo vroeg mogelijk afspraken met een notifying body maken. Want deze notifying body moet eerst nog zelf bepalen of het competent is om het product/medische software te kunnen beoordelen. Daarom heeft het de ‘intended purpose’ nodig. Als je dan weet dat de doorlooptijd bij de notifying bodies varieert van 9 tot 18 maanden, begrijp je meteen waarom je het best zo snel mogelijk begint aan de MDR certificering. Zo komt alles alsnog binnen de wettelijke termijn in orde.
MDR en het belang van “foreseeable misuse”
Onder MDR groeit ook de aandacht voor ‘voorspelbaar misbruik’ (foreseeable misuse) — een verantwoordelijkheid van de leverancier én de klant.
Heb je ooit nagedacht over de intended purpose van je medisch hulpmiddel? Gebruik je het product inderdaad daarvoor, of ook voor andere doeleinden?
Zo zijn er bijvoorbeeld allerlei medische apps die niet bedoeld zijn om patiënten te monitoren, maar wel hiervoor gebruikt worden. Dit betekent risico’s voor jou. En je kunt je afvragen of dit meer een gadget is dat de investering niet waard is? Indien je een medische hulpmiddel niet gebruikt conform de intended purpose, kun je niet meer vertrouwen op de CE certificering en heb je geen zekerheid meer dat het product veilig doet wat je ervan verwacht.
Samengevat: van MDD naar MDR
MDR is een Europese regelgeving. Uiteraard zijn er daardoor gevolgen op nationaal niveau in Nederland en België. In Nederland bijvoorbeeld, gebruikt de Inspectie Gezondheidszorg en Jeugd (IGJ) Eudamed voor zijn toezicht, net als de FAGG in België. Daarom is het ook voor hen relevant om meteen te starten met het stappenplan:
- inventariseren van de data waarop de MDD-certificeringen verlopen
- navragen of er al een Eudamed-registratie met SRN-code is
- aangeven wie de Person Responsibe for Regulatory Compliance is
- de MDR intended purpose use bestuderen en navragen of er een wijziging in de CE klasse komt
- controleren welke notifying body gecontracteerd is en of er al een MDR planning beschikbaar is
Dankzij de ervaring en specifieke kennis over de Nederlandse en Belgische zorgomgeving helpt itemedical ziekenhuizen om zich tijdig voor te bereiden op de MDR en verrassingen te voorkomen.
Nuttige links
OSMI – De beroepsverenigingen NVKI (Nederlandse Vereniging van Klinisch Informatici) en de BMTZ (Beroepsvereniging voor Biomedisch Technologen) hebben het initiatief genomen tot oprichten van het OSMI platform (Overview software MDR & IVDR).
Eudamed – Eudamed database: vergroot transparantie
Rijksoverheid – Registratie van gegevens in Eudamed
Controleer hier de MDD certificatie status van medische software die itemedical levert
Controleer hier de MDD certificatie status van medische software die Itémedical levert